本 期 要 目
[焦点关注]
李克强签署国务院令 公布《中华人民共和国人类遗传资源管理条例》
广告审查管理办法今年第二次征求意见 “三品一械”将延长广告批准文号有效期
药品追溯体系出新文件了
[监管动态]
国家药典委发布《人用基因治疗制品总论》(草案)
7个化学仿制药注射剂要接受注册生产现场检查
国家局发布重组人凝血因子Ⅷ临床试验技术指导原则和重组人凝血因子Ⅸ临床试验技术指导原则的通告
国家局发布修订注射用甲泼尼龙琥珀酸钠说明书的公告
国家局发布注销盐酸吡格列酮片等15个药品批准文号的公告
[综合分析]
57个中药保护品种今年期满!
近3年609张GMP被收,看点在这里
[国外信息]
2019年5月全球最新获批药品和器械清单
全球在研药物深度透视:最热的治疗领域与适应症
2018美国化学仿制药市场概览
美国新药特殊审评制度优秀经验借鉴
焦点关注
李克强签署国务院令 公布《中华人民共和国人类遗传资源管理条例》
据新华社消息,日前,国务院总理李克强签署国务院令,公布《中华人民共和国人类遗传资源管理条例》(以下简称《条例》),自2019年7月1日起施行。
一是加大保护力度。《条例》规定,国家开展人类遗传资源调查,对重要遗传家系和特定地区人类遗传资源实行申报登记制度。外国组织及外国组织、个人设立或者实际控制的机构需要利用我国人类遗传资源开展科学研究活动的,采取与中方单位合作的方式进行。将人类遗传资源信息对外提供或者开放使用的,应当备案并提交信息备份,可能影响我国公众健康、国家安全和社会公共利益的,应当通过安全审查。
二是促进合理利用。《条例》规定,国家支持合理利用人类遗传资源开展科学研究、发展生物医药产业、提高诊疗技术,提高我国生物安全保障能力,提升人民健康保障水平;有关部门要统筹规划,合理布局,加强创新体系建设,促进生物科技和产业创新、协调发展;对利用人类遗传资源开展研究开发活动以及成果的产业化依照法律、行政法规和国家有关规定予以支持。
三是加强规范。《条例》规定,采集、保藏、利用、对外提供我国人类遗传资源,不得危害我国公众健康、国家安全和社会公共利益,应当符合伦理原则,保护资源提供者的合法权益,遵守相应的技术规范。开展生物技术研究开发活动或者临床试验,应当遵守有关生物技术研究、临床应用管理法律、行政法规和国家有关规定。《条例》对采集、保藏我国人类遗传资源,利用我国人类遗传资源开展国际合作科学研究等审批事项,明确了审批条件,完善了审批程序。
四是优化服务监管。《条例》要求,科学技术行政部门应当在方便申请人利用互联网办理审批、备案事项等方面优化和改进服务,加强对采集、保藏、利用、对外提供人类遗传资源活动各环节的监督检查。同时完善了相关法律责任,加大了处罚力度。
条例原文:http://www.gov.cn/zhengce/content/2019-06/10/content_5398829.htm
来源:中国政府网
广告审查管理办法今年第二次征求意见 “三品一械”将延长广告批准文号有效期
6月6日,国家市场监管总局发布《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理办法(征求意见稿)》(以下简称征求意见稿),这是今年3月13日以来,国家市场监管总局就该管理办法第二次公开征求意见。
征求意见稿共五章三十三条,内容包括总则、广告审查标准、广告审查程序、法律责任、附则,对药品、医疗器械、保健食品、特殊医学用途配方食品(以下简称“三品一械”)广告审查的立法依据、适用范围、主管部门、内容标准、审查程序、法律责任等作了全面规定。
与现行审查办法相比,征求意见稿分别对“三品一械”广告应当显著标明的内容和广告审查所需证明材料进行了精简。删除生产企业名称、产品注册证明文件或者备案凭证编号等需要显著表明的内容;药品、医疗器械、保健食品广告审查证明材料分别减少了4项、2项、6项。此外,还延长了广告批准文号有效期,规定广告批准文号的有效期由申请人自行确定,但不得超过产品注册证明文件或备案凭证有效期的截止日期。产品注册证明文件或者备案凭证未规定有效期的,广告批准文号有效期不得超过五年。
国家市场监管总局表示,征求意见稿集中体现了审查标准的“严”和审查程序的“宽”两个特点。“严”,是按“四个最严”要求做好食品药品监管工作,从严规定广告内容审查标准;“宽”,则体现了按照“放管服”改革要求,进一步简化流程、优化服务。
原文:http://www.saic.gov.cn/hd/zjdc/201906/t20190606_302244.html
来源:市场监管总局广告司
药品追溯体系出新文件了
近日,中国政府网转发了来自商务部的《关于协同推进肉菜中药材等重要产品信息化追溯体系建设的意见》。
意见指出,为贯彻落实党中央、国务院决策部署,进一步提升食品安全和消费安全保障水平,推动追溯试点示范转化为制度性成果,构建长效工作机制,5月31日,商务部、工业和信息化部、农业农村部、海关总署、国家市场监督管理总局、国家中医药管理局、国家药品监督管理局联合印发了《关于协同推进肉菜中药材等重要产品信息化追溯体系建设的意见》(商秩字〔2019〕5号,以下简称《意见》)。
《意见》指出:追溯体系建设是强化质量安全监管、保障放心消费和公共安全、服务消费升级的重要举措。《国务院办公厅关于加快推进重要产品追溯体系建设的意见》(国办发〔2015〕95号)印发以来,各地各部门积极行动,有效提升产品质量安全保障水平,但在工作机制协同、平台互联互通等方面还需要加强和完善。
《意见》提出:中医药管理部门结合中药标准化工作,推动中药材生产经营企业履行追溯主体责任、建设中药材质量追溯体系。
药监部门会同有关部门推动药品生产经营企业建立覆盖生产、流通等全过程的追溯体系。
探索建立追溯平台市场化对接管理机制,鼓励各类生产经营企业、协会和第三方追溯系统接入行业或地区追溯管理或信息协同平台。
农业农村、市场监管、中医药管理、药监等部门分头推进食用农产品、食品、中药材、药品等重要产品各领域的追溯专用标准制修订和应用推广工作。
原文:http://www.gov.cn/xinwen/2019-06/06/content_5397924.htm
来源:中国政府网
监管动态
国家药典委发布《人用基因治疗制品总论》(草案)
按照2020版《中国药典》编制大纲规划,我委于2017年立项开展相关研究工作拟建立人用基因治疗制品总论,现已完成相关起草复核工作。为确保标准的科学性、合理性和适用性,现公示征求社会各界意见(详见附件)。公示期为三个月。请相关单位认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。来函需加盖公章,收文单位为“ 国家药典委员会办公室 ”,同时将公函扫描件电子版发送至指定邮箱。公示期满未回复意见即视为对公示总论草案无异议。
原文:http://www.chp.org.cn/view/ff8080816a583947016b400a6458575e?a=BZSWZP
来源:国家药典委员会
7个化学仿制药注射剂要接受注册生产现场检查
按《药品注册管理办法》《国家药品监督管理局关于加强化学仿制药注射剂注册申请现场检查工作的公告》(2018年第20号)的要求,我中心计划对注射用艾司奥美拉唑钠等7个品种(规格)开展注册生产现场检查(详见附件)。如在通告的检查时间内,注册申请人不能接受现场检查,需在通告后10个工作日内,主动向我中心提出撤回现场检查的书面申请(邮寄或现场递交)。10个工作日后,注册申请人不得撤回现场检查申请。
附件:化学仿制药注射剂注册生产现场检查计划
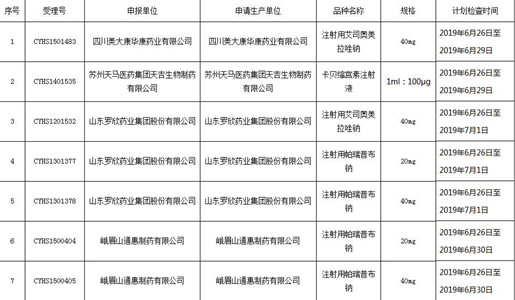
原文:http://www.cfdi.org.cn/resource/news/11520.html
来源:国家药品监督管理局食品药品审核查验中心
国家局发布重组人凝血因子Ⅷ临床试验技术指导原则和重组人凝血因子Ⅸ临床试验技术指导原则的通告
为规范和指导重组人凝血因子Ⅷ和重组人凝血因子Ⅸ制品临床试验的实施,促进该类制品的良性发展,国家药品监督管理局组织制定了《重组人凝血因子Ⅷ临床试验技术指导原则》和《重组人凝血因子Ⅸ临床试验技术指导原则》(见附件1和附件2),现予发布。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338200.html
来源:国家药监局
国家局发布修订注射用甲泼尼龙琥珀酸钠说明书的公告
为进一步保障公众用药安全,国家药品监督管理局决定对含牛源性乳糖的注射用甲泼尼龙琥珀酸钠说明书【禁忌】、【注意事项】项进行修订。现将有关事项公告如下:
一、所有含牛源性乳糖的注射用甲泼尼龙琥珀酸钠生产企业均应依据《药品注册管理办法》等有关规定,按照注射用甲泼尼龙琥珀酸钠说明书修订要求(见附件),提出修订说明书的补充申请,于2019年8月3日前报省级药品监管部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在补充申请备案后6个月内对所有已出厂的药品说明书及标签予以更换。
上述含牛源性乳糖的注射用甲泼尼龙琥珀酸钠生产企业应当对新增不良反应发生机制开展深入研究,采取有效措施做好使用和安全性问题的宣传培训,涉及用药安全的内容变更要立即以适当方式通知药品经营和使用单位,指导医师、药师合理用药。
二、临床医师、药师应当仔细阅读注射用甲泼尼龙琥珀酸钠说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的效益/风险分析。
三、患者应严格遵医嘱用药,用药前应当仔细阅读说明书。
原文:http://www.nmpa.gov.cn/WS04/CL2115/338217.html
来源:国家药监局
国家局发布注销盐酸吡格列酮片等15个药品批准文号的公告
根据《中华人民共和国药品管理法实施条例》和《药品注册管理办法》的有关规定,国家药品监督管理局决定注销盐酸吡格列酮片等15个药品批准文号。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338261.html
来源:国家药监局
综合分析
57个中药保护品种今年期满!
据国家药监局官网数据显示,正在受保护的中药保护品种达193个,于2019年陆续到期的品种达57个(以“药品名称+生产企业”为统计标准),均为2级保护品种,保护期限为7年。
据米内网数据统计,上述57个品种中,在2017年中国公立医疗机构终端以及中国城市零售药店终端合计销售额超过10亿的大品种有两个,包括了上海绿谷制药的注射用丹参多酚酸盐以及北京以岭药业的参松养心胶囊,此外,超亿元的品种有18个。
20个品种销售超亿元,心血管、脑血管疾病用药最火热
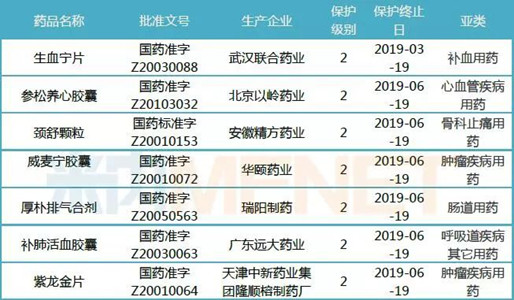
表1:20个销售超亿元并于2019年保护终止的中药保护品种
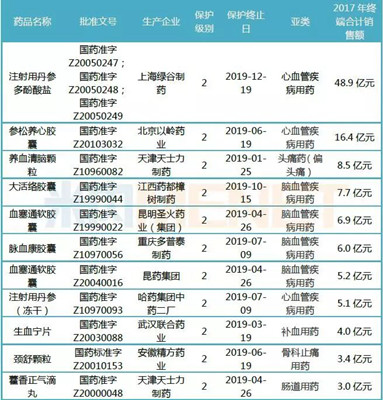
(来源:米内网数据库、国家药监局官网)
据米内网数据统计,2017年中国公立医疗机构终端(即中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院)以及中国城市零售药店终端合计销售额超1亿的品种有20个,其中脑血管疾病用药有6个,心血管疾病用药有4个。
上述超10亿大品种中,上海绿谷制药的注射用丹参多酚酸盐2017年终端合计销售额为48.9亿元,该产品为独家品种,主要销售市场为中国公立医疗机构终端,2017年在中成药心血管疾病用药产品TOP20中排在首位。2017版国家医保目录对部分中药注射剂限制了使用范围,注射用丹参多酚酸盐限二级及以上医疗机构并有明确冠心病、心绞痛诊断患者,销售增长率轻微下滑了0.15%。上海绿谷制药的注射用丹参多酚酸盐为2级保护品种,保护起始日为2012年12月19日,保护终止日为2019年12月19日。
另一个超10亿大品种是北京以岭药业的参松养心胶囊,2017年终端合计销售额为16.4亿元,该产品为独家品种。2017年在中国公立医疗机构终端中成药心血管疾病用药产品TOP20中排在第十一位,增长率为8.35%;在中国城市零售药店终端中成药心血管疾病用药产品TOP20中排第九位,增长率为3.27%。北京以岭药业的参松养心胶囊为2级保护品种,保护起始日为2012年6月19日,保护终止日为2019年6月19日。
40个品种延期期满,17个品种或将申请延期
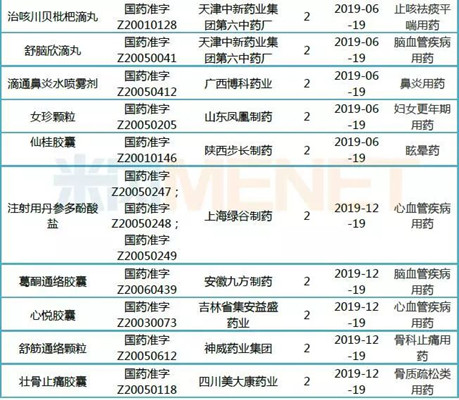
表2:40个已获延期并于2019年期满的中药保护品种

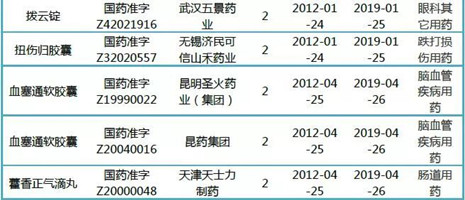


(来源:米内网中国中药保护品种目录数据库)
《中药品种保护条例》在1992年10月14日发布,1993年1月1日起施行,其中第十六条提到,中药二级保护品种在保护期满后可以延长七年。
上述40个品种,均已查到延期公告,并于2019年期满。其中不乏多个销售超亿元的产品:养血清脑颗粒、大活络胶囊、血塞通软胶囊、脉血康胶囊、血塞通软胶囊、注射用丹参(冻干)、藿香正气滴丸、脉血康胶囊、四妙丸、通窍鼻炎颗粒、玉屏风胶囊(销售额及企业信息见表1)。
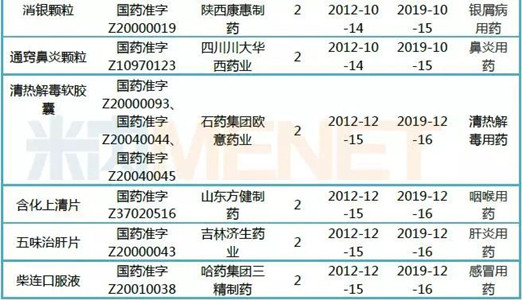
表3:17个有望申请延期的中药保护品种
(来源:米内网中国中药保护品种目录数据库)
57个2019年期满的中药保护品种中有17个暂无延期公告,本次期满后,仍有机会申请延长保护期,相关药企需要在保护期满前六个月申报。我们也将继续关注上述品种的后续情况。
中药保护品种制度,未来该如何走下去?
中药品种保护是国家药监局根据《中药品种保护条例》有关规定对符合规定的特定中药品种授予《中药保护品种证书》,且在一定期限内只允许获得《中药保护品种证书》的企业进行生产的一种保护制度。
中药保护条例是行政法规,是国家层面从行政保护的角度为中药生产企业提供的保障措施之一。中药品种保护没有新颖性的要求,对于一些已经公开了产品发明、方法发明、用途发明等信息的中药产品,是无法申请专利保护的,这样的产品可以通过申请中药品种保护获得一定的保护。中药品种保护制度的实施,很大程度上解决了中药生产品种的低水平重复问题,改善企业间的无序竞争,一定程度上促进中药产业的现代化、集约化和规模化发展。
但随着我国制剂国际化进程越来越兴旺,很多中药大品种都渴望走出国门,获得世界的认同。《中药品种保护条例》第二十一条提到,中药保护品种在保护期内向国外申请注册的,须经国务院药品监督管理部门批准。这无疑令相关企业左右为难。
今年两会期间,全国政协委员、上海中医药大学附属曙光医院原副院长蒋健提到要推动我国中药品种保护制度与国际知识产权规则接轨的问题。他表示。目前我国中药品种的保护期限超出了专利的保护期限,可能导致相关企业偏重于中药品种保护而不是中药专利保护,创新热情不高,且与世卫组织《与贸易有关的知识产权协议》的药品政策不协调。他建议将一级保护品种调整为20年、10年,二级保护品种可仍定为7年;并进一步完善申请延期保护的条件,突出临床疗效及中药质量控制水平,从严把控,以促进企业创新、杜绝无技术含量的简单改进。
对于中药品种保护,您又有何看法呢?留言给我们一起讨论吧。
来源:国家药监局官网、米内网数据库
近3年609张GMP被收,看点在这里
注意:
1、数据从国家局、各省局及各平台汇总,不可避免存在遗漏;
2、所得数据与目前各平台公布的数据有所差异,仅供参考;
3、2019年数据统计截止至2019年5月30日。
随着国家监管力度的加强,近年来被收回GMP收证的企业逐年增加,汇总了2016年1月-2019年5月全国收回GMP证书的情况,并做了简单的分析。
据不完全统计:
2016年全国共收回172张GMP证书
2017年全国共收回159张GMP证书
2018年全国共收回236张GMP证书
截止至2019年5月30日,2019年全国收回GMP证书42张。
合计,近三年收证609张。
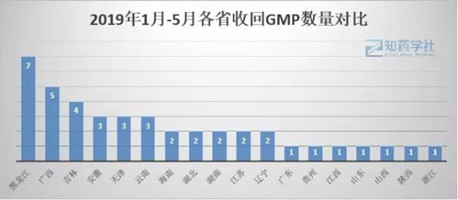
2019年各地区企业被收回证书情况:黑龙江7张,广西5张,吉林4张,安徽、天津、云南各3张,海南、湖北、湖南、江苏、辽宁各2张,广东、贵州、江西、山东、山西、陕西、浙江各1张,其余各省未公布。
哪些省份收证最积极?
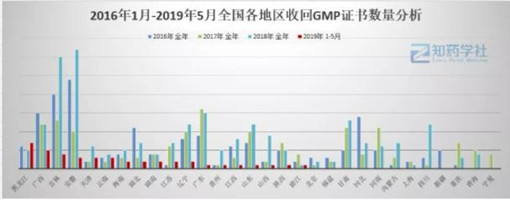
从统计的数据得出,近三年被收回GMP省份排名:
安徽省排名第一,被收证合计69张;
吉林省排名第二,被收证合计67张;
广西省排名第三,收证数量为44张;
广东省排名第四,收证数量为41张;
辽宁省排名第五,收证数量为32张。
哪类药品易被收证?
对2016年1月-2019年5月收回GMP的产品类别进行对比,其中中药饮片和口服制剂占大部分,口服制剂中化药占16%,中药占84%,中药和中药饮片是收证的重灾区。
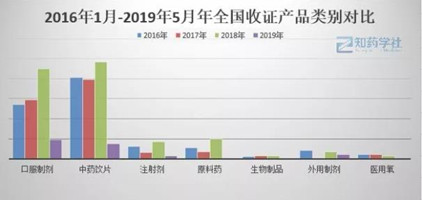
截止至2019年5月仅公布了42张证书被收回的情况,似乎预示着2019年GMP证书收回数量将有所下降,是否可说明药监部门对药品生产企业监管更加宽松了?
哪些月份是药企的“黑色月份”?
对近三年各月份收回GMP证书数量进行了对比。
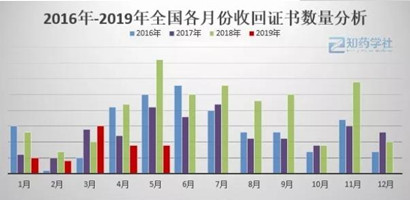
从图中可以看出,药企的“黑色”月份是集中在上半年的5月、6月、7月,下半年11月份也有抬头的趋势。
近期监管重点
目前已有9个省份公布了2019年的监管重点,多个省份提出创新监管方式,全面推行“双随机、一公开”监管机制,加大对通过仿制药一致性评价品种特别是中标药品生产企业现场检查力度。
其中广东省、广西省、辽宁省、福建省将疫苗产品、血液制品、注射剂列为2019年监管重点:
2019年2月14日广东省局发布的《广东省药品监督管理局 2019年工作要点 》明确要求省级药监部门要选派检查员入驻疫苗生产企业,每家企业派驻检查员不少于两人,定期轮换并挂牌公示,负责监督检查企业执行药品生产质量管理规范的情况,收集质量安全风险和违法违规线索。
2018年12月27日国家局发布《关于加强药品集中采购和使用试点期间药品监管工作》的通知,要求加强药品生产监管,加大对通过仿制药一致性评价品种特别是中标药品生产企业的现场检查力度,重点检查企业风险隐患排查责任落实情况、生产质量管理规范实施情况、数据真实可靠情况,严格落实原辅料质量控制,严控源头质量风险情况,严格按照批准的处方工艺组织生产情况,涉及委托生产的,落实委托生产质量管理情况。
2019年5月21日,国家局发布《关于加快推进药品智慧监管的行动计划》的通知,明确到2020年,建立起符合信息技术发展趋势的药品监管信息化建设技术与应用框架。在此基础上,再经过3—5年的时间,推进信息技术与监管工作深度融合,形成“严管”加“巧管”的监管新局面的目标。
长春长生事件发生正处于国家机构改革和药品管理法体系改革的关键时期,2019年征求意见的《药品管理法(修订草案)》对违法行为加大了处罚力度,可以看出未来国家对药品质量监管将更加严格。其实药品关乎人的生命健康,无论国家监管形势如何,都应该守住药品安全底线。
来源:知药学社、蒲公英
国外信息
2019年5月全球最新获批药品和器械清单
2019年5月,欧美批准新药中孤儿药占据半壁江山,取代抗肿瘤药物成为新的研发热点。国内的注册审评格局趋势良好,相比进口器械,占明显优势。
一、全球药品获批情况
2019年5月药品审评数据发布,欧美批准新药中孤儿药占据半壁江山,取代抗肿瘤药物成为新的研发热点。
为加快境外已上市临床急需新药的审批通道,国家药监局遴选了2批境外已上市的临床急需境外新药名单共74个,骨巨细胞瘤用药地舒单抗注射液、重组带状疱疹疫苗(CHO细胞)、丙肝治疗新药格卡瑞韦哌仑他韦片都于5月获批;2019年5月5日,国内豪森药业自主研发的一类新药孚来美成功上市。
(一)美国FDA批准情况
2019年以来,美国受理批准总数达457个,陆续已有44款NDA/BLA药品(不包含暂批药物)获批,相对往年较为平稳。
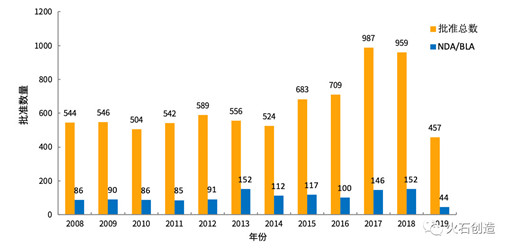
图1 2010—2019年FDA批准药物情况
2019年5月,FDA共批准药品74个,其中NDA/BLA批准7个(不包含暂批药物),相对上月(批准总数106件,NDA/BLA 13件)批准数量显著减少, 其中有2个新分子实体和2个新活性成分药物被批准。
表1 2019年5月FDA批准NDA/BLA列表
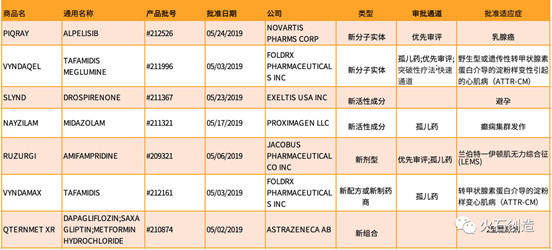
获批的7款新药中孤儿药有4款,占57.1%,提示孤儿药研发备受FDA关注。其中有几款新药值得关注,具体情况如下:
(1)5月24日,PIQRAY获得FDA批准,该产品是NOVARTIS研发的一种口服小分子PI3K抑制剂,与氟维司群联用用于治疗患有HR+/HER2-、PIK3CA-突变的晚期或转移性乳腺癌的绝经后妇女和男性患者。大约40%的HR+/HER2-晚期乳腺癌患者伴有PIK3CA基因突变,PI3K通路的改变与肿瘤恶化、治疗耐药性和疾病进展相关,PIQRAY是首个专门针对PIK3CA突变的HR+/HER2-晚期乳腺癌的治疗药物。
(2)5月23日,SLYND获得FDA批准,该产品是Exeltis开发的一种口服避孕药,通过抑制排卵来降低怀孕风险,它是一种合成黄体酮,药理作用与天然孕酮相似。SLYND可以改善出血状况,具有更大的灵活性,能够保持避孕效果长达24小时,其临床疗效和安全性在一项超过3000多名患者参与的临床试验中得到了验证,试验结果显示,SLYND的临床疗效可与复方激素类避孕(CHCs)媲美,但参与实验的所有女性,包括高危人群,都没有发生过血栓栓塞。
(3)5月17日,NAYZILAM获得FDA批准,该产品是一种苯二氮卓类药物,用于12岁及以上癫痫患者集群性发作的紧急治疗。此前Nayzilam(咪达唑仑)获得FDA的孤儿药资格,它是首个也是唯一一个FDA批准的治疗癫痫集群性发作的鼻喷雾剂,允许非医疗专业人员在癫痫发作时及时对患者进行管理。确切作用机制尚不完全清楚,但据悉可能通过增强GAGB能神经元传递的活性,促进GABA与相应受体结合。Nayzilam于2018年6月被比利时的UCB公司以3.7亿美元收购,用于扩充其癫痫研发管线。
(4)5月3日,VYNDAQEL获得FDA批准,该产品是FoldRx制药公司研发的一种口服转甲状腺素蛋白稳定剂,用于治疗成人转甲状腺素蛋白介导的淀粉样变心脏病 (ATTR-CM)。ATTR-CM是一种罕见的致命性心脏病,VYNDAQEL是第一个且目前唯一获得FDA批准治疗ATTR-CM的药物。2010年,辉瑞通过收购FoldRx制药公司从而获得tafamidis,EMA在于2011年11月16日批准了VYNDAQEL在整个欧盟的上市许可。FDA授予VYNDAQEL孤儿药、快速通道、优先审评和突破性疗法认定,以帮助和鼓励这种罕见疾病药物的开发。
(二)欧盟EMA批准情况
截至2019年5月31日,EMA批准上市的药品共计25个,批准数量与往年相比有明显下降(36个)。新活性物质(New active substance,NAS)7个,较2018年同期有所减少,但较前几年相对平稳。见图2。
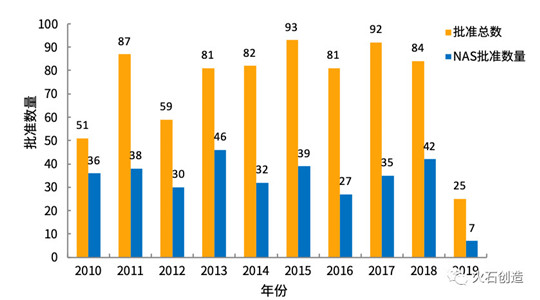
图2 EMA历年批准药物情况
2019年5月,EMA共批准了3个药品,包含新活性物质药2个、仿制药1个。见表2。
表2 2019年5月EMA批准的药物列表
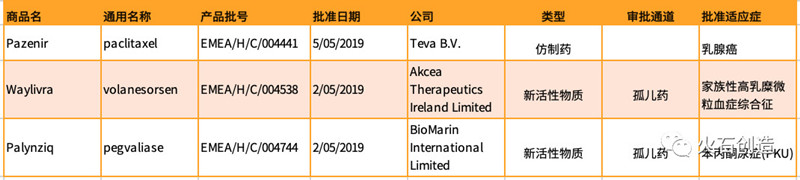
5月获批产品中孤儿药2个,分别为Waylivra和Palynziq,具体情况如下:
(1)5月2日,Waylivra获得EMA批准,该产品用于治疗家族性高乳糜微粒血症综合征(FCS)。Waylivra是一种反义寡核苷酸(ASO)抑制剂,通过减少ApoC-III的产生,从而调节血浆甘油三酯。Waylivr于2014年获得过EMA的孤儿药认定,FCS是一种非常罕见的具有毁灭性的疾病。它是由脂蛋白脂肪酶(LPL)功能受损引起,患者面临着急性胰腺炎以及永久性器官损伤而引起的慢性并发症的潜在风险。据估计,全世界约有3000至5000人患有FCS,欧洲约有1000人患有FCS。
(2)5月2日,Palynziq获得EMA批准,该产品用于无法充分控制血苯丙氨酸水平(血苯丙氨酸超过600µmol/L)的16岁及以上苯丙酮尿症(PKU)患者的治疗。Palynziq是一种由大肠杆菌产生的聚乙二醇化重组苯丙氨酸解氨酶 (rAvPAL),用以替代缺失的苯丙氨酸羟化酶(PAH),以降低血液中苯丙氨酸的水平。Palynziq是一种新型酶替代疗法,曾获得FDA孤儿药认定,并于2018年在美国上市许可。
(三)NMPA批准情况
2019年5月,NMPA共批准药品上市52件,其中国产药品41件,进口药品11件。除去剂型后,共43个品种,获批产品类型分布情况见图3。
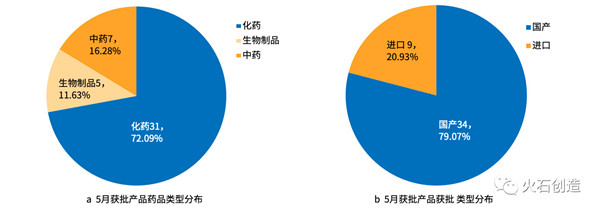
图3 5月获批产品类型分布
表3 5月获批品种超过2种的企业名单
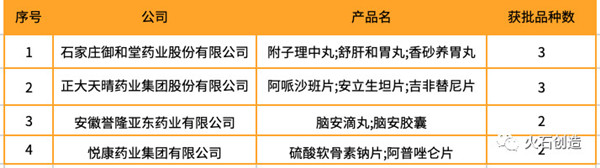
5月获批药品中,国产1类新药和进口1类新药各1个,临床急需境外已上市药品3个。其中通过CDE优先审评程序获批4个。见表4。
表4 2019年5月NMPA批准的新药列表
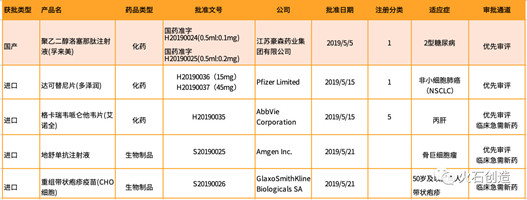
本月批准的药品中有几个值得关注,具体情况如下:
(1)5月5日,聚乙二醇洛塞那肽注射液(商品名:孚来美®)获得1类创新药的上市许可,该产品是江苏豪森研发的长效GLP-1受体激动剂,可促进葡萄糖依赖的胰岛素分泌,用于成人改善2型糖尿病患者的血糖控制,只需每周注射1次。
GLP-1受体激动剂类药物是近年来降糖药物的一个研发热点,豪森药业的聚乙二醇洛塞那肽注射液是国内首个获批的长效GLP-1制剂,此前获批的周制剂包括阿斯利康百达扬(艾塞那肽)和礼来的度易达(度拉糖肽),均为进口制剂,聚乙二醇洛塞那肽注射液的上市将为2型糖尿病患者提供新的治疗选择。
(2)5月15日,达可替尼片(商品名:多泽润®)获NMPA批准,该产品是辉瑞公司研发的二代EGFR靶向药物,用于表皮生长因子受体(EGFR)19号外显子缺失突变或21号外显子L858R置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。多泽润®的获批是基于一项关键性国际多中心III期临床研究ARCHER-1050的积极数据,与吉非替尼相比,无进展生存期显著延长,死亡或疾病进展风险显著降低。此次获批在中国首次实现几乎与美国、欧洲、日本等国家的全球同步递交并获得监管部门的批准。
(3)骨巨细胞瘤用药地舒单抗注射液、带状疱疹用药重组带状疱疹疫苗(CHO细胞)分别因罕见病用药、国内缺少对该病有效的预防和治疗手段被列入首批48个临床急需新药名单。
(4)艾伯维的丙肝治疗新药格卡瑞韦哌仑他韦片(商品名:艾诺全),凭借“与现有治疗手段相比具有明显治疗优势”于2019年5月29日被列入CDE发布的“第二批临床急需境外新药名单”。
国家药监局2018年开始对临床急需的境外已上市新药另设“高速通道”,加速罕见病以及严重危及生命疾病新药审评审批,截至目前,共发布了2批74个品种,已经批准了16个品种的进口注册。
二、全球医疗器械获批情况
根据2019年5月医疗器械审评数据,提示5月份国内注册审评格局趋势良好,相比进口器械有明显优势。国内自主研发的2个医疗器械获得创新医疗器械资格认定并进入特别审批通道。
(一)美国FDA批准情况
根据数据统计,2019年5月,FDA共批准252个产品,其中通过上市前通知510(k)途径上市248 个,包括一类器械14个,二类器械227个,未分类7个;通过上市前批准(PMA)途径上市的医疗器械产品4个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,矫形外科和心血管类产品获批上市最多,见图5。

图5 2019年5月通过FDA 510(k)途径获批上市产品类型分布情况
(二)境内批准情况
1.医疗器械进入特别审批程序和优先审批程序情况
2019年5月,共有2个医疗器械获得创新医疗器械资格认定并进入特别审批程序,分别是深圳硅基智能科技有限公司研发的糖尿病视网膜病变分析软件和苏州康多机器人有限公司研发的内窥镜手术系统。
同时,有8个医疗器械被纳入医疗器械优先审批程序,其中进口1个,国产7个。杭州优思达生物技术有限公司研发的结核分枝杆菌复合群核酸检测试剂盒因“国家科技重大专项的医疗器械”而被纳入优先审批,美敦力的“传送鞘管”因“临床急需,且在我国尚无同品种产品获准注册的医疗器械”而被纳入优先审批。
2.国家局批准首次注册医疗器械产品情况
2019年5月,国家局共批准首次注册医疗器械产品 212个,其中境内第三类(含体外诊断试剂)医疗器械产品 57个;进口医疗器械产品155 个,包括一类103 个、二类 23 个和三类29个。
截至2019年5月31日,各省级药品监管部门共批准境内第二类医疗器械注册321个,一类备案医疗器械364个,提示国内医疗器械的发展潜力良好。
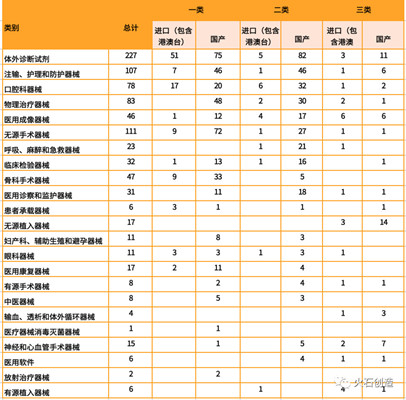
统计数据显示,体外诊断试剂数量最多,共227项,占25%,其中国产最多,有168项,占74%。该类别绝大部分是试剂盒、质控品和校准品等体外诊断分析试剂。除体外诊断试剂外,批准注册类别排前三位的分别为无源手术器械、注输、护理和防护器械和物理治疗器械。
表5 2019年5月境内、进口医疗器械批准注册类别数目分布情况
从地区分布上,境内注册产品生产企业主要集中在沿海经济较发达省份。其中,广东、浙江、上海和北京境内医疗器械注册数量较多。见图6。

图6 境内获批器械区域分布
来源:火石创造
全球在研药物深度透视:最热的治疗领域与适应症
根据最新数据,截至2019年1月,全球在研新药数量为16181个,与2018年的15267个相比,同比增幅为5.99%。
16个主要治疗领域:TOP 2抗癌药、生物药高速扩张
当按照主要治疗领域对在研新药项目进行分类时发现,2019年各治疗领域的在研新药数量增速各异。通过Pharmaprojects数据库,对16个主要治疗领域以及生物技术类别的在研药物情况进行分析。
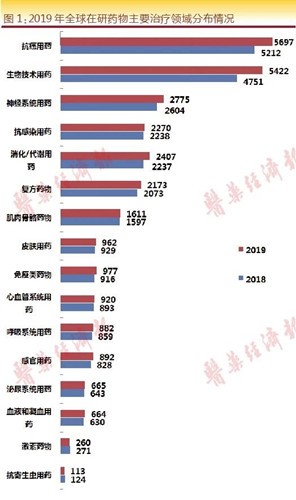
整体来看,抗癌药物、生物技术类药物、神经系统药物、抗感染药物和消化/代谢药物为排名居TOP5的治疗领域,与2018年排名基本一致。
其中,癌症是药品研发的重要适应症领域,抗癌/抗肿瘤药物数量继续保持稳定增长态势,数量已从2018年的5212个增至5697个,候选药物增加了485个,增幅高达9.3%,高于6%的制药研发行业平均增速。
生物技术类药物数量同样保持大幅增长势头,数量已从2018年的4751个增至5422个,增幅高达14.1%。需要注意的是,随着癌症治疗方法逐渐向更为靶向的生物技术疗法倾斜,更多药物将被统计在这两个子领域中。
此外,增速超过行业平均增速的治疗领域还包括神经系统用药(增幅为6.6%)、消化/代谢用药(增幅为7.6%)、免疫类药物(增幅为6.7%)以及感官用药(增幅为7.7%)。
与全球制药企业在抗肿瘤药物领域投入持续增加相比,部分治疗领域的在研药物数量出现了显著下滑。例如,2019年抗寄生虫用药和激素药物数量分别同比下降8.9%和4.1%。
另外,一些治疗领域的在研药物数量仅有小幅变化。例如,2019年抗感染用药数量增幅仅为1.4%,肌肉骨骼药物增幅仅为0.9%,都远低于行业平均增速,且与往年增幅相比,这些类别的药物数量增幅都较为有限。
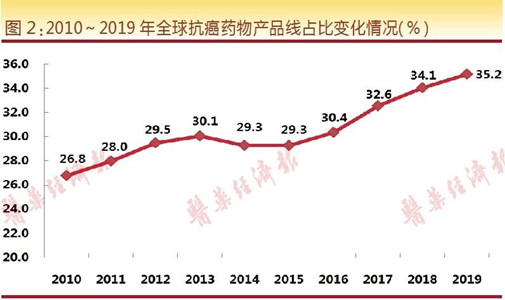
从现有统计数据来看,抗癌/抗肿瘤药物基本已占据新药研发的绝对主导地位,其数量呈现逐年增长态势。从2010-2019年全球抗癌药物产品线占比变化情况来看,在研的抗肿瘤药物数量保持持续稳定增长势头,其数量占比已从2010年的26.8%增至2019年的35.2%。这意味着,超过三分之一的在研药物开发目标为肿瘤疾病。不难看出,整个行业的资源在向抗肿瘤药物领域倾斜。而在资源有限的背景下,这种资源的过度倾斜,有可能会对其他同样重要的临床治疗需求产生影响。
236个细分治疗类别:免疫类抗癌药首登榜首,基因疗法增势最猛
将16个治疗领域的药物细分为236个治疗类别,并与2018年数据进行对比,可反映不同治疗类别在研药物数量的变化情况。

从治疗类别TOP25排名中发现,免疫类抗癌药(在研药物2731个)、一般抗癌药(2450个)、基因疗法(864个)、其他单克隆抗体药物(818个)、抗感染预防性疫苗(702个)为排名居前五位的治疗类别。
总体来看,两类主要的抗癌/抗肿瘤药物多年来一直位居榜单前列,但今年的情况有所不同。免疫类抗癌药物增长较为迅猛,位居第1位,这也是自2003年以来该类药物首次荣登榜首,2019年其增幅高达16.5%。一般抗癌药排名已下降至第2位,2019年在研药物数量增幅仅为3.2%。从这些信息不难看出,包括单克隆抗体、CAR-T细胞疗法以及肿瘤免疫学技术在内的免疫学疗法正在癌症治疗中发挥愈加重要的作用。
在这些治疗类别中,最引人注意的类别当属基因疗法,该类别已从2018年排名第6位上升至第3位,在研药物数量也已从2018年的633个增至864个,增幅高达36.5%。基因疗法自20世纪90年代兴起,数据记录最早可追溯至1995年,1996年时其在研药物数量已超过100个,其后经历了在研药物数量的快速增长,并于2003年达到275个的峰值,当年排名位居TOP25的第3位,后因临床试验中受试者死亡导致该类药物发展受到影响,其在研药物数量基本维持在200个左右,排名顺序持续下滑,且未见明显复苏迹象,在2012年和2014年均跌出了TOP25行列。
随着全球第一例基因治疗药物,即荷兰UniQure公司研发药物Glybera(alipogene tiparvovec)首次获得欧盟委员会批准后,该类药物的研发态势才出现回暖,并于2015年重返TOP25榜单。自此,我们既能看到传统基因疗法产品,如Spark Therapeutics公司的Luxturna(voretigene neparvovec),也能看到与离体基因疗法相关的新的治疗技术如CAR-T和CRISPR技术。
从统计数据来看,多数治疗类别均呈现出产品线扩张的态势。其中,单克隆抗体药物数量继续保持稳定增长态势,其三种亚类均已进入TOP25之列,且每种亚类均出现在研药物数量的增长。
然而,也有一些治疗类别的表现并不尽如人意。2019年,抗感染预防性疫苗在研药物数量出现了小幅下滑,其排名已从第3位下降至第5位;降幅最为明显的治疗类别为糖尿病治疗药物,尽管其排名仍然维持在第7位,但其在研药物数量已从2018年的605个下降至571个,降幅达5.6%。
超过1400种适应症:TOP 5全部、TOP 10有8种、TOP 20有14种为抗癌药
进一步按照在研药物的适应症进行统计,可将其归入数量超过1400种的疾病或适应症,其中超过470种疾病为官方或权威机构认定的罕见病。
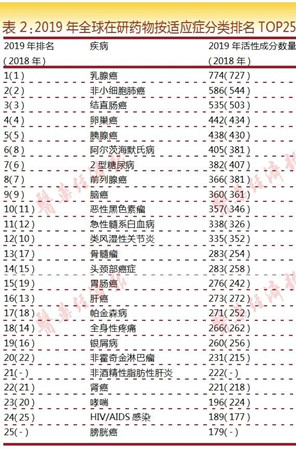
与2018年的排名情况相比,各适应症的排位顺序未见明显变化。全球在研药物TOP5适应症包括乳腺癌(在研药物数量为774个)、非小细胞肺癌(586个)、结直肠癌(535个)、卵巢癌(442个)和胰腺癌(438个)。其中,乳腺癌继续稳居排名第一位,其在研药物数量同比增长6.5%;非小细胞肺癌以7.7%的增幅位居第二,增速较为明显;结直肠癌增幅为6.4%,位居第三位;卵巢癌和胰腺癌,增幅均为1.8%。TOP5适应症均为癌症,这种情况已是连续第二次出现。
在排名TOP15的疾病类别中,除前列腺癌和脑癌外,与癌症相关的多数适应症均呈现增长态势。除排名居前五的癌症类别外,还有前列腺癌(366个)、脑癌(360)、恶性黑色素瘤(357个)、骨髓瘤(283个)、头颈部癌症(283)、胃肠癌(276个),增幅分别为-3.9%、-0.3%、3.2%、11.4%、9.7%、14.0%。入围TOP25中的癌症类别还包括肝癌(273个)、非霍奇金淋巴瘤(231个)、肾癌(221个)和膀胱癌(179个)。与其他类型的药物相比,抗肿瘤药物常被用于多种疾病的治疗,因此从统计数据来看,抗癌/抗肿瘤药物的排名也会比较靠前。在TOP10中有8种药物为抗癌药物,而在TOP20中则有14种药物为抗癌药物。
从在研药物数量的增幅来看,胃肠癌(增幅为14.0%)、骨髓瘤(11.4%)、头颈部癌症(9.7%)、非小细胞肺癌(7.7%)和帕金森病(7.5%)均为增幅较大的适应症类别。
而哮喘(降幅为12.5%)、2型糖尿病(降6.1%)、类风湿性关节炎(降4.8%)和前列腺癌(降3.9%)等适应症类别的在研药物数量则出现了不同程度的下滑。
此外,新进入TOP25排名的热门适应症为非酒精性脂肪性肝炎,在研药物数量为222个,位列第21位。
来源:医药经济报
2018美国化学仿制药市场概览
一、市场规模
2009-2018十年间,全球医药市场规模不断扩大,近5年复合增长率为6.3%,2018年已达12000亿美元。预计未来5年这一数字仍将继续增长,2023年有望突破15000亿美元。
详细信息请见:http://www.pharmcube.com/news/article/3970?index=news
来源:医药魔方
美国新药特殊审评制度优秀经验借鉴
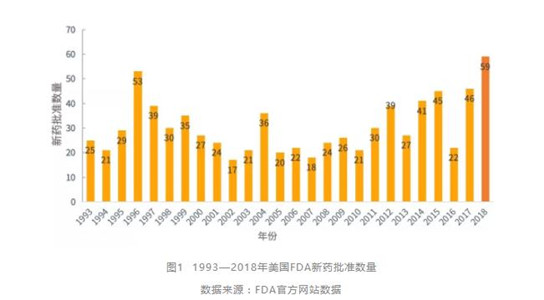
2018年,美国FDA共批准了59款新药,是近26年来新药核准数量最多的一年,从一个侧面反映出美国政府优化法规监管、加速新药上市的政策倾向。
一、美国新药特殊审评制度概况
美国从自身国情出发,设立了多种新药特殊审评模式。FDA主要有四种新药加快审批途径,分别是快速通道、加速审批、突破性疗法和优先审评。
1. 快速通道:针对治疗严重疾病且目前临床用药空缺的新药
严重疾病包括代表性的艾滋病、心衰、癌症和阿尔茨海默病,以及癫痫、抑郁和糖尿病等。解决尚未满足的医疗需求指提供一种新的治疗药物或优于现有药物的治疗药物。
药企主动提出快速通道指定申请,可与临床研究申请(IND)一同提出,或在IND提交后任何时候提出,但建议在生物制品许可申请(BLA)或新药申请(NDA)会议之前,FDA在收到申请后60天内给出答复。快速通道需要提供非临床和临床数据,表明该药具备解决医疗需求不足的潜力。满足医疗需求不足可分为提供目前没有的治疗药物或提供优于现有治疗的药物。
2.加速审批:针对目前临床用药空缺、基于替代终点而批准的新药
满足以下三个条件可获得加速审批:一是用于治疗严重疾病,二是对于现有疗法具有优势,三是显示具有改善代理终点表现的新药。
申请人应在新药研发过程中与FDA审评人员沟通,探讨可否应用代理终点指标,以及验证性临床试验(指在新药批准后的临床试验)等有关问题。FDA回应加速审批申请的时限并无明确规定。
3.突破性疗法:针对明显改善现有疗法的新药
满足以下两个条件可认定为突破性治疗药物:一是适应证为危及生命的或严重的疾病,二是有证据显示在某一重要临床终点上明显优于现有药物。
制药企业可将突破性治疗药物资格申请与IND一同提交,或在IND提交后任何阶段,但建议不晚于Ⅱ期临床试验会议结束,FDA在收到申请60天内给予答复。如果该药物不再满足突破性治疗药物指定的资格,FDA将撤销对其的指定。突破性治疗药物需要提供初步的临床证据表明该药能够实质性改善现有治疗药物的临床终点。
4.优先审评:在申请受理后6个月内完成审评的新药
优先审评适用于治疗严重疾病且一旦获得批准,对现有疗法的安全性或有效性改善显著的新药(可以是首次新药申请,也可以是已上市药品的疗效补充申请),也适用于认定为抗感染的新药或治疗某些热带疾病的新药。
在递交新药生产申请(NDA)、或生物制品生产申请(BLA)、或递交相关补充申请时,申请优先审评。FDA在收到申请60天内给予答复,并于6个月内完成审评。
二、美国新药特殊审评模式对于我国的借鉴
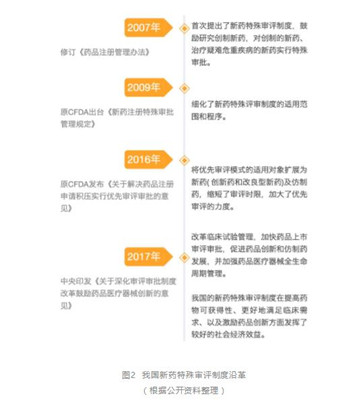
1.我国新药特殊审评制度的沿革
近年来我国出台一系列文件,建立和完善新药特殊审评制度。
2.美国新药特殊审评制度对于我国的借鉴
从作用机制来看,我国与美国采用的审评机制大体相同,即为优先审评的新药优先配置资源。由于美国新药特殊审评制度建立较早,相对更为成熟,对于我国具有不少可供借鉴之处:
(1)通过细化关键审评步骤的时间节点加快审评速度。美国的新药特殊审批制度中设置了归档会议、中期会议等几个重要审评节点,从而缩短新药审批用时。
(2)实行新药审评项目经理制度,减少沟通成本,提高审评效率。美国设立新药审评项目经理,由其联系、协调申请人与审评机构,推动审评工作顺利进行。
(3)建立细分领域的专业审评室,增强审评的专业性和科学性。美国根据适应证的不同,建立了血液学和肿瘤、代谢和内分泌等多个审评办公室。各审评室由项目经理、药理/毒理学专家、临床药理学/生物药剂学专家、化学家/生物学家专家、医务人员、统计学专家组成。通过不同领域专家的充分交流与通力合作,保证审评决策的科学性。
三、完善我国新药特殊审评制度的建议
1. 设置更为明确的新药特殊审评时间节点
目前的新药特殊审评制度对于药品检验、现场检查和沟通交流的时限作出了一些规定,但对于整个技术审评时限尚未明确,制度实施上具有一定的随意性。
建议设置特殊审评整体审评时限,明确“立卷审查”、“技术审评报告”、“三合一综合审评”、“获批上市”等重要节点的审评时限,同时加大各机构之间的沟通协调力度,缩短新药特殊审评的周期。
2. 优化新药特殊审评适用范围的分类标准
当前我国新药特殊审评制度适用范围的分类标准仍不够清晰。既有根据适应证和结构的分类标准,还包含了国家重大新药创制专项和国家重点研发计划的药品和主动撤回重新申报的品种。
今后应进一步明确适用范围的分类标准,避免各种不同类别的申请都拥挤在同一通道,一定程度上增加了监管难度。可考虑对于创新药和改良型新药按照新药通道管理,临床急需的首仿药按照仿制药通道管理,从源头上对创新药和仿制药实施差异化管理。由于短时期内我国创新药数量相对较少,建议加大对于改良型新药的重视,适当提高改良型新药的占比。
3. 加强新药特殊审评相关配套制度的建设
继续探索建立新药特殊审评项目管理人制度,扩大项目管理人的职能范围,与审评团队共同负责审评过程,协调申请人与审评机构之间的交流,管理相关审评文件,充分参与审评过程中各个环节的工作。
探索成立以临床审评人员为核心,药理、毒理、药学和统计等多专业审评人员与项目管理人员共同参与的适应证专业审评团队,提高审评决策的科学性和合理性。
来源:火石创造