本 期 要 目
[监管动态]
国家药监局 国家卫生健康委发布定制式医疗器械监督管理规定(试行)的公告
国家药监局发布批准注册158个医疗器械产品的公告
国家药监局发布口腔数字印模仪注册技术审查指导原则的通告
国家药监局发布国家医疗器械监督抽检结果的通告
国家药监局发布《医疗器械产品注册项目立卷审查要求(试行)》等文件的通告
国家药监局发布将化妆品中3-亚苄基樟脑等22种防晒剂的检测方法纳入化妆品安全技术规范(2015年版)的通告
[综合分析]
2019年上半年CDE最新:91个药品入选,新药申请超50%
2019年6月中国1类新药临床动态
[国外信息]
2019年6月全球批准新药概况
盘点6月全球最新获批药品和器械清单
欧美市场2019年上半年生物类似药审评进展
欧洲药典10.0颁布!2020年1月1日起实施
监管动态
国家药监局 国家卫生健康委发布定制式医疗器械监督管理规定(试行)的公告
为规范定制式医疗器械注册监督管理,保障定制式医疗器械的安全性、有效性,满足患者个性化需求,根据《国务院关于修改〈医疗器械监督管理条例〉的决定》(中华人民共和国国务院令第680号)规定,国家药品监督管理局会同国家卫生健康委员会制定了《定制式医疗器械监督管理规定(试行)》,现予发布,自2020年1月1日起施行。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338728.html
来源:国家药监局
国家药监局发布批准注册158个医疗器械产品的公告
2019年5月,国家药品监督管理局共批准注册医疗器械产品158个。其中,境内第三类医疗器械产品91个,进口第三类医疗器械产品38个,进口第二类医疗器械产品28个,港澳台1个(具体产品见附件)。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338727.html
来源:国家药监局
国家药监局发布口腔数字印模仪注册技术审查指导原则的通告
为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了口腔数字印模仪注册技术审查指导原则(见附件),现予发布。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338726.html
来源:国家药监局
国家药监局发布国家医疗器械监督抽检结果的通告
为加强医疗器械质量监督管理,保障医疗器械产品使用安全有效,国家药品监督管理局组织对血液透析器、血液透析设备、外科缝线(针)等29个品种共965批(台)产品进行了质量监督抽检。具体情况通告如下:
被抽检项目不符合标准规定的医疗器械产品,涉及57家企业的16个品种61批(台)。具体为:
(一)腹部穿刺器2家企业2批次产品。杭州桐庐医疗光学仪器有限公司生产的1批次腹腔镜配套手术器械(穿刺器),密封性和阻气性、硬度不符合标准规定;桐庐康尔医疗器械有限公司生产的1批次一次性使用腹腔镜用穿刺器,配合性能不符合标准规定。
(二)高电位治疗设备4家企业4台产品。滁州国康医疗仪器有限公司生产的1台高电位治疗仪,随机文件、外壳和防护罩、输出电压不符合标准规定;株式会社利百世(代理商:上海日晨医疗器械有限公司)生产的1台高压电位治疗仪,指示灯和按钮、输出电压、输出频率不符合标准规定;苏州久久寿医疗器械有限公司生产的1台高压电位治疗仪,结构和布线不符合标准规定;南京唐沃医疗科技有限公司生产的1台高压电位治疗仪,随机文件不符合标准规定。
(三)髋关节假体1家企业1批次产品。天新福(北京)医疗器材股份有限公司生产的1批次髋关节假体(钴铬钼)钴铬钼股骨柄、髋关节假体(钴铬钼)钴铬钼股骨头,股骨球头锥连接的直径、锥度、直线度和圆度不符合标准规定。
(四)连续性血液净化设备1家企业1台产品。Infomed S.A.(代理商:广州德朗医疗设备有限公司)生产的1台连续性血液净化设备,静脉压监控不符合标准规定。
(五)软性接触镜2家企业2批次产品。Vision Science Co,Ltd.(代理商:科尔视医疗器械(上海)有限公司)生产的1批次软性亲水接触镜,折射率不符合标准规定;SEED Co.,Ltd.(代理商:实瞳(上海)商贸有限公司)生产的1批次软性亲水接触镜Soft Hydrophilic Contact Lenses,总直径不符合标准规定。
(六)特定电磁波治疗仪5家企业5台产品。四川恒明科技开发有限公司生产的1台特定电磁波谱治疗器,防护件、防护罩的表面容许的最高温度不符合标准规定;重庆戈嘉商贸有限公司生产的1台特定电磁波(TDP)治疗器,控制器的操作部件、正常使用时的稳定性不符合标准规定;重庆萍丰机械有限公司、重庆欣尚医疗器械有限公司生产的各1台特定电磁波治疗器,控制器的操作部件不符合标准规定;安徽乐金健康科技股份有限公司生产的1台红外频谱理疗装置,随机文件(GB 9706.1-2007、YY 0306-2008)不符合标准规定。
(七)天然胶乳橡胶避孕套6家企业7批次产品。济宁卫康胶业有限公司生产的1批次天然胶乳橡胶避孕套,未经老化爆破体积和爆破压力、针孔不符合标准规定;菏泽康神药业有限公司生产的2批次、高平市丹阳橡胶制品有限公司、茂名市江源乳胶制品有限公司生产的各1批次天然胶乳橡胶避孕套,未经老化爆破体积和爆破压力不符合标准规定;Suretex Prophylactics (lndia) Limited(代理商:武汉杰士邦卫生用品有限公司咸宁分公司)、马来西亚英诺雷特橡胶工业有限公司(代理商:天际国际贸易(上海)有限公司)生产的各1批次天然胶乳橡胶避孕套,针孔不符合标准规定。
(八)外科缝线(针)7家企业7批次产品。宁波市成和显微器械厂生产的1批次带线缝合针、Arthrex,Inc.(代理商:锐适医疗器械(上海)有限公司)生产的1批次非吸收性外科缝线、苏州市嘉盛医疗用品有限公司生产的1批次非吸收性外科缝线(蚕丝线)、Ethicon LLC(代理商:强生(上海)医疗器材有限公司)生产的1批次聚酯不可吸收缝合线、ETHICON,LLC(代理商:强生(上海)医疗器材有限公司)生产的1批次可吸收性缝线、江苏明环医用品有限公司生产的1批次带线缝合针,缝线线径不符合标准规定;上海元洪医疗器械有限公司生产的1批次带线缝合针(医用涤纶编织线),针线连接强度不符合标准规定。
(九)微波治疗设备4家企业5台产品。广东康业医疗设备有限公司生产的1台微波治疗仪,输入功率、正常工作温度下的连续漏电流和患者辅助电流不符合标准规定;重庆蜀明科技发展有限公司生产的1台微波治疗机,随机文件不符合标准规定;南京福中医疗高科有限公司生产的1台微波治疗仪、南京维京九洲医疗器械研发中心生产的1台微波治疗仪和1台微波消融治疗仪,正常工作温度下的连续漏电流和患者辅助电流不符合标准规定。
(十)血液透析器1家企业1批次产品。贝恩医疗设备(广州)有限公司生产的1批次空心纤维血液透析器,清除率不符合标准规定。
(十一)血液透析设备1家企业1台产品。重庆澳凯龙医疗科技股份有限公司生产的1台血液透析机,正常检验过程中开机无法正常使用,不符合标准规定。
(十二)牙科光固化机7家企业7台产品。佛山市安答科技有限公司生产的1台LED光固化机,正常工作温度下的连续漏电流和患者辅助电流、指示器不符合标准规定;COLT?NE/WHALEDENT INC.(代理商:康特威尔登特齿科贸易(北京)有限公司)生产的1台LED光固化机、佛山市南海区靓雅齿科器材有限公司生产的1台光固化机、DENTLIGHT INC.(代理商:北京固琦口腔科技有限公司)和佛山市西耐德医疗器械有限公司生产的各1台牙科光固化机,正常工作温度下的连续漏电流和患者辅助电流不符合标准规定;佛山市宇森医疗器械有限公司生产的1台LED光固化机、贝思德迩医疗器材(广州)有限公司生产的1台光固化机,指示灯和按钮不符合标准规定。
(十三)一次性使用便携式输注泵非电驱动4家企业4批次产品。江苏省华星医疗器械实业有限公司、南京扬子医用制品有限公司、南京宁创医疗设备有限公司、山东天工医用品开发有限公司生产的各1批次一次性使用输注泵,紫外吸光度不符合标准规定。
(十四)一次性使用无菌导尿管1家企业1批次产品。哈尔滨吉圣科技发展有限公司医疗器械分公司生产的1批次一次性使用无菌导尿包,EO残留量不符合标准规定。
(十五)一次性使用医用口罩7家企业9批次产品。河南瑞科医疗器械有限公司生产的1批次一次性使用医用口罩,口罩带、细菌过滤效率(BFE)不符合标准规定;河南省华裕医疗器械有限公司和新乡市医邦卫生材料有限公司生产的各1批次一次性使用医用口罩、新乡市大方医疗器械制造有限公司生产的2批次医用口罩,口罩带不符合标准规定;河南省豫北卫材有限公司和南昌市凯旋医疗器械有限公司生产的各1批次一次性使用医用口罩、邵阳智康医疗器械有限公司生产的2批次一次性使用医用口罩,细菌过滤效率(BFE)不符合标准规定。
(十六)医用外科口罩4家企业4批次产品。苏州新纶超净技术有限公司生产的1批次医用外科口罩,口罩带不符合标准规定;吴江市亿成医疗器械有限公司生产的1批次一次性使用医用外科口罩、河南省蓝天医疗器械有限公司和南昌卫材医疗器械有限公司生产的各1批次医用外科口罩,压力差(Δp)不符合标准规定。
以上抽检不符合标准规定产品具体情况,见附件1。
二、被抽检项目为标识标签、说明书等项目不符合标准规定的医疗器械产品,涉及11家企业的6个品种12台,具体为:
(一)高电位治疗设备3家企业3台产品。滁州国康医疗仪器有限公司生产的1台高电位治疗仪、苏州久久寿医疗器械有限公司生产的1台高压电位治疗仪,控制器和仪表的标记不符合标准规定;南京唐沃医疗科技有限公司生产的1台高压电位治疗仪,设备或设备部件的外部标记不符合标准规定。
(二)连续性血液净化设备1家企业1台产品。Infomed S.A.(代理商:广州德朗医疗设备有限公司)生产的1台连续性血液净化设备,设备或设备部件的外部标记不符合标准规定。
(三)特定电磁波治疗仪1家企业1台产品。四川恒明科技开发有限公司生产的1台特定电磁波谱治疗器,设备或设备部件的外部标记、警示标记不符合标准规定。
(四)微波治疗设备3家企业4台产品。南京维京九洲医疗器械研发中心生产的1台微波消融治疗仪,设备或设备部件的外部标记、设备的外部标记不符合标准规定;重庆蜀明科技发展有限公司生产的1台微波治疗机、南京福中医疗高科有限公司和南京维京九洲医疗器械研发中心生产的各1台微波治疗仪,设备或设备部件的外部标记不符合标准规定。
(五)无创自动测量血压计(电子血压计)1家企业1台产品。深圳市乐中行科技有限公司生产的1台手臂式电子血压计,标识要求不符合标准规定。
(六)牙科光固化机2家企业2台产品。贝思德迩医疗器材(广州)有限公司生产的1台光固化机、DENTLIGHT INC.(代理商:北京固琦口腔科技有限公司)生产的1台牙科光固化机,设备或设备部件的外部标记不符合标准规定。
以上抽检不符合标准规定产品具体情况,见附件2。
三、抽检项目全部符合标准规定的医疗器械产品涉及419家企业的23个品种903批(台),见附件3。
四、对上述抽检中发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门督促相关企业按照《医疗器械监督管理条例》《医疗器械召回管理办法》等法规规章要求对抽检不符合标准规定的产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息。同时,企业应尽快查明产品不合格原因,制定整改措施并按期整改到位,有关处置情况于2019年7月10日前向社会公布,并及时将相关情况报告所在地省级药品监督管理部门。
五、企业所在地省级药品监督管理部门应对相关企业进行调查处理,对企业进行产品召回、不合格原因调查、落实整改措施及公开披露信息等情况进行监督;如产品对人体造成伤害或者有证据证明可能危害人体健康的,应依法采取暂停生产、经营、使用等紧急控制措施;需要暂停进口的,应及时报国家药品监督管理局作出行政处理决定。企业未按要求落实上述要求的,所在地省级药品监督管理部门要依法严肃查处。有关信息应及时向社会公开。
六、以上各项落实情况,相关省级药品监督管理部门于2019年7月20日前报告国家药品监督管理局。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338836.html
来源:国家药监局
国家药监局发布《医疗器械产品注册项目立卷审查要求(试行)》等文件的通告
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),配合医疗器械注册电子申报工作的开展,根据《医疗器械注册管理办法》(原国家食品药品监督管理总局令第4号)、《体外诊断试剂注册管理办法》(原国家食品药品监督管理总局令第5号)、《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(原国家食品药品监督管理总局公告2014年第43号)、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(原国家食品药品监督管理总局公告2014年第44号)等文件要求,国家药品监督管理局组织制定了《医疗器械产品注册项目立卷审查要求(试行)》等立卷审查要求。
国家药品监督管理局医疗器械技术审评中心在受理环节按照立卷审查要求对相应申请的申报资料进行审查,对申报资料进入技术审评环节的完整性、合规性、一致性进行判断。立卷审查不对产品安全性、有效性评价的合理性、充分性进行分析,不对产品风险受益比进行判定。立卷审查适用于医疗器械注册、许可事项变更、临床试验审批等申请事项。
现予发布,自2019年9月1日起实施。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338933.html
来源:国家药监局
国家药监局发布将化妆品中3-亚苄基樟脑等22种防晒剂的检测方法纳入化妆品安全技术规范(2015年版)的通告
国家药品监督管理局组织起草了《化妆品中3-亚苄基樟脑等22种防晒剂的检测方法》,经化妆品标准专家委员会全体会议审议通过,现予以发布,并作为第5.8项纳入《化妆品安全技术规范(2015年版)》第四章。
原文:http://www.nmpa.gov.cn/WS04/CL2138/338953.html
来源:国家药监局
综合分析
2019年上半年CDE最新:91个药品入选,新药申请超50%
2019年上半年(H1)国家药监局药品审评中心(CDE)一共将91个药品申请纳入优先审评,91个药品申请全部为申请上市生产,其中新药申请50个,仿制药申请41个;国产药品申请65个,进口药品申请26个。
一、药品优先审评总体情况
自2016年药品优先审评制度实施,全国已经共有867个受理号的药品被纳入了优先审评,包括568个国产药品和299个进口药品,499个新药申请和368个仿制药申请。
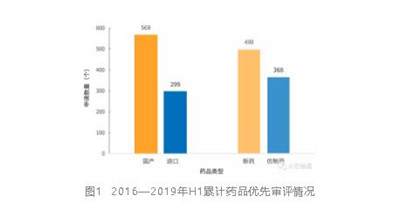
从历年纳入优先审评的药品申请数量上来看,优先审评实施的前三年,每年被纳入优先审评的药品申请数量加快上升,但2019年上半年的数量则明显减少。
2019年1—6月共有91个受理号的药品被纳入优先审评,较去年同期(167个)下降45.5%,预计全年的数量有可能创历史新低。

二、2019年H1 优先审评药品特征分析
1. 药品类型
从药品类型来看,91个药品申请中新药申请50个,包括化药28个、生物制品21个和中药1个;仿制药申请均为化药,有41个,占比高达75.8%,依然占据明显优势。随着生物制品申请的逐年增加,化药比例正逐渐下降,从侧面折射出当前医药市场上生物药发展势头迅猛的现状。

2. 申请类型
从申请类型来看,没有临床或补充申请,91个药品申请全部为申请上市生产,其中国产和进口药品申请分别有65和26个,新药申请占比分别为36.9%和100%。
3.地域分布
从注册申请人的地域分布情况来看,91个药品申请最主要分布在上海、北京、江苏、广东和浙江等生物医药产业大省,其中作为跨国医药巨头集聚的北京和上海,则囊括了大部分的进口新药申请。
从生物制品的申请数量来看,北京和上海同样领先于其他地区,反映出这两个地区在生物药领域拥有着更好的产业基础和更好的发展趋势。
4.申请人和品种分布
从申请人和品种的分布情况来看,跨国制药巨头占据优势。诺华、赛诺菲和阿斯利康被纳入优先审评的药品申请数分别为6、4和3个,领先于其他公司。
国内药企东莞市阳之康医药被纳入优先审评的药品申请有6个,贝达药业、上海安毕生、天津天药药业以岭万洲国际制药和海正药业均有3个。
三、重点品种介绍
1. 纳武利尤单抗注射液
作为全球首个PD-1抑制剂,百时美施贵宝的纳武利尤单抗注射液(欧狄沃)于2018年6月在中国获批,8月在中国上市,用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
目前纳武利尤单抗注射液在全球已获批了17项适应症和9个癌种。国内正在开展的临床试验中,除了肺癌、肝癌等全球领域的常见高发癌肿,一些针对食管癌、胃癌等国内高发癌症种类的临床试验也在进展中。此次该药拟纳入优先审评,意味着其在中国将获批新的适应症。
2. 阿达木单抗注射液
阿达木单抗注射液(修美乐)是全球首个获批上市的全人源抗肿瘤坏死因子单克隆抗体,2002年在美国获批上市,作为免疫类药物,目前修美乐在全球获批的适应症多达14个,在超过96个国家或地区销售,至2016年,修美乐已经连续五年成为全球销量第一的生物制剂,并保持高速增长。
修美乐于2010年在中国上市,目前只有三个适应症在华获批,同时,也面临着国内齐鲁制药、正大天晴、海正药业、信达生物等众多企业的阿达木单抗生物类似物的仿制药申报带来的压力。值得一提的是,复宏汉霖和信达生物的阿达木单抗注射液也同样在2019年上半年被纳入优先审评。
3. 替雷利珠单抗注射液
6月17日,百济神州与新基公司(CELG)达成共识,终止双方关于百济神州在研抗PD-1抗体替雷利珠单抗的全球合作,收回该款药物的全球授权。而仅过去10天不到的时间,百济神州的替雷利珠单抗注射液就被纳入了优先审评。
作为替雷利珠单抗的主要竞争对手之一,恒瑞医药的人源化抗PD-1抗体——注射用卡瑞利珠单抗也有一个上市申请在上半年被纳入优先审评,并且比替雷利珠单抗早了接近一个月的时间。而注射用卡瑞利珠单抗在今年的5月已经获得了国家药监局核准的注册批件。
四、小结
随着2018年底国家药监局药审中心日前发出通知,明确对申请人提出的优先审评申请采取即到即审方式组织专家进行审核,确定优先审评品种,药品优先审评将进一步加速。从2019年上半年的药品优先审评情况来看,生物制品占比升高、重磅药品加速上市等,也顺应了产业发展的态势和要求。
来源:火石创造
2019年6月中国1类新药临床动态
2019年6月,共有3个中国1类化药获得国家药品监督管理局(NMPA)的临床试验默示许可。
详细信息请见:https://news.pharmacodia.com/news/html/info/info-detail.html?id=39958
来源:药渡
国外信息
2019年6月全球批准新药概况
2019年6月,美国食品药品监督管理局FDA批准1个生物制品和1个新分子实体(NME),分别是治疗弥漫大B细胞淋巴瘤的Polatuzumab vedotin和治疗绝经前妇女性欲障碍的Bremelanotide。日本医药品医疗器械综合机构PMDA批准2个新分子实体(NME),分别是治疗实体瘤的Entrectinib和治疗急性骨髓性白血病的Quizartinib Hydrochloride。
详细信息请见:https://news.pharmacodia.com/news/html/info/info-detail.html?id=39955
来源:药渡
盘点6月全球最新获批药品和器械清单
2019年6月,欧美和中国药品上市获批数量较上月均有所减少。国产医疗器械的注册审评格局趋势良好,相比进口器械优势明显。
详细信息请见:https://mp.weixin.qq.com/s/XtBWFth7HiftRMZ5-rbomQ
来源:火石创造
欧美市场2019年上半年生物类似药审评进展
生物药品属于大分子物质,因此欧美官方对于生物类似药和参比生物制品之间的等效性问题,一直保持谨慎态度。随着生物类似药公司的不断努力,并得到欧美官方的法规支持,欧美生物类似药在近几年的注册情况有明显好转。
欧美药品法规监管态度一直是全球各国药政当局所关注的,对于生物类似药的管理要求,也被各国药政当局所关注。相比美国FDA的更保守态度而言,欧盟对于生物类似药的态度更积极,截止目前为止,欧盟针对生物类似药的法规和指南也颁布的最多、最全面。
在2015年度,中国国家药监局也开始推进生物类似药的审批工作。2019年春天,复宏汉霖的汉利康以生物类似药身份获批,解开了中国生物类似药法规注册的新篇章。
本文汇总并分析在2019年上半年中,欧美市场获批的生物类似药情况。
详细信息请见:https://www.cphi.cn/news/show-170337.html
来源:CPhI制药在线
欧洲药典10.0颁布!2020年1月1日起实施
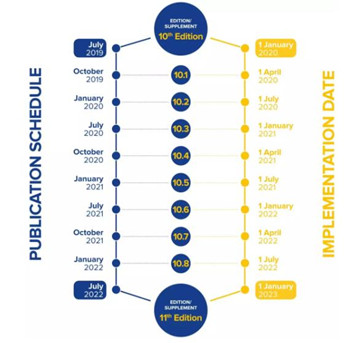
近日,欧洲药典10.0发布,其中新增章节和修订的章节将于2020年1月1日生效,此外还有部分作了修正的章节,要求制药公司最迟不得迟于2019年8月31日作出变更!具体如下:
The 10th edition of the Ph. Eur.will be released in July 2019 and will be updated with eight supplements over the next 3 years (10.1 to 10.8). The new and revised Texts of the 10th Edition will become official on 1 January 2020.
欧洲药典第十版,将于2019年7月发布,并将在未来3年(10.1至10.8)更新8个增补本。第十版的新文本和修订文本将于2020年1月1日正式生效。
As of the 10th Edition of the Ph. Eur.,
欧洲药典10.0版内容:
﹒revised and / or corrected parts of texts are indicated by vertical lines (print version),
文本的修改和/或更正已用竖线标出(印刷版)
﹒horizontal lines indicate where parts of texts have been deleted (print version),
划线表示文本已被删除(印刷版)
﹒a QR Code is included at the start of each text, providing a link to further information (e.g. the Knowledge database),
每篇文章的开头都有二维码,提供进一步信息的链接(如知识库)
﹒the wording used in the calculation of percentage contents in tests for related substances has been modified to specify the full name of the substance (i.e. including counter-ions, hydrates etc.),
对有关物质检测中计算百分含量的措辞进行了修改,明确了该物质的全称(包括反离子、水合物等),
﹒tests using diphosphorus pentoxide, mainly tests for loss on drying, have been modified to avoid the use of this substance due to its toxicity,
需要使用五氧化二磷的测试,主要是干燥失重测试,已经进行了修改,以避免使用这种有毒物质,
﹒the names and descriptions of the reagents used to describe stationary GC phases have been revised,
修改气相色谱固定相的试剂的名称和描述,
﹒‘Tamper-proof ’ has been replaced by ‘tamper-evident’,
术语‘Tamper-proof ’改为‘tamper-evident’,
﹒reference to general chapter 2.8.23. Microscopic examination of herbal drugs has been added when microscopic examination is carried out using a powder with a non-standard sieve size,
通则第2.8.23《草药显微镜检查》:当使用非标准筛尺寸的粉末进行显微镜检查时,增加了参考文献
﹒the terms ‘coarse’ and ‘coarsely’ have been deleted from ‘coarse powder’ and ‘coarsely powdered herbal drug’ (2.9.12. Sieve test),
“粗”和“粗的”两词已从“粗粉”和“植物药粗粉”中删除(2.9.12筛分试验),
﹒results are expressed in per cent instead of per cent m/m in the tests 2.8.16 Dry residue of extracts and 2.8.17 Loss on drying of extracts.
在2.8.16萃取物干燥残渣和2.8.17萃取物干燥损失的测试中,结果用百分数表示,而不是用百分数m/m表示。
新增内容:
The following texts appear for the first time in the European Pharmacopoeia. They will be implemented on 1 January 2020at the latest.
新增以下章节,它们最迟将于2020年1月1日生效!
﹒2.6.35. Quantification and characterisation of residual host-cell DNA
残留宿主细胞DNA的定量和定性
﹒2.9.49. Powder flow properties by shear cell methods
剪切细胞方法检查粉末流动特性
﹒2.9.52. Scanning electron microscopy
扫描电子显微镜
﹒3.3. Containers for human blood and blood components, and materials used in their manufacture; transfusion sets and materials used in their manufacture; syringes
用于人体血液和血液成分的容器及其制造中使用的材料;输血套及其生产物料;注射器
﹒5.25. Process analytical technology
过程分析技术

修订部分:
The following texts have been technically revised since their last publication. Theywill be implemented on 1 January 2020 at the latest.
以下章节作了技术性的修订,它们最迟将于2020年1月1日生效!
﹒2.2.25. Absorption spectrophotometry, ultraviolet and visible
紫外可见吸收分光光度法
﹒2.6.8. Pyrogens
热原
﹒2.6.33. Residual pertussis toxin
百日咳毒素残留
﹒2.7.2. Microbiological assay of antibiotics
抗生素微生物测定
﹒2.7.23. Numeration of CD34/CD45+ cells in haematopoietic products
造血产品中CD34/CD45+细胞的计数
﹒2.7.35. Immunonephelometry for vaccine component assay
免疫比浊法测定疫苗成分
﹒2.8.25. High-performance thin-layer chromatography of herbal drugs and herbal drug preparations
中药和中药制剂的高效薄层色谱
﹒2.9.1. Disintegration of tablets and capsules
片剂和胶囊的崩解
﹒2.9.20. Particulate contamination: visible particles
颗粒污染:可见颗粒
﹒3.1.13. Plastic additives
塑料添加剂
﹒3.3.1. Materials for containers for human blood and blood components
人体血液和血液成分容器的材料
﹒3.3.2. Materials based on plasticised poly(vinyl chloride) for containers for human blood and blood components
用于人体血液和血液成分容器的塑料聚合物(氯乙烯) 材料
﹒3.3.3. Materials based on plasticised poly(vinyl chloride) for tubing used in sets for the transfusion of blood and blood components
用于血液和血液成分输液器管材的塑料聚合物(氯乙烯) 材料
﹒3.3.4. Sterile plastic containers for human blood and blood components
用于人体血液和血液成分的无菌塑料容器
﹒3.3.5. Empty sterile containers of plasticised poly(vinyl chloride) for human blood and blood components
用于人体血液和血液成分的塑料聚合物(氯乙烯)无菌空容器
﹒3.3.6. Sterile containers of plasticised poly(vinyl chloride) for human blood containing anticoagulant solution
用于人体血液(含有抗凝液)的塑料聚合物 (氯乙烯)无菌容器
﹒3.3.7. Sets for the transfusion of blood and blood components
用于输送血液和血液成分的装置
﹒3.3.8. Sterile single-use plastic syringes
无菌一次性塑料注射器
﹒4. Reagents
试剂
﹒5.3. Statistical analysis of results of biological assays and tests
生物含量结果的统计分析和检验
﹒5.8. Pharmacopoeial harmonisation
药典协调
﹒5.21. Chemometric methods applied to analytical data
应用于分析数据的化学测量方法
﹒5.22. Names of herbal drugs used in traditional Chinese medicine
中药用草药名称
﹒5.24. Chemical imaging
化学成像


修正的部分
The following texts have been corrected for the 10th Edition and specify ‘corrected 10.0’ above the title. These corrections are to be taken into account as soon as possible and not later than 31 August 2019 (the end of the month following the month of publication of the 10th Edition).
以下章节作了修正,并在其标题上标注了“10.0版修正”应尽快考虑这些修正,并最迟不得迟于2019年8月31日。
﹒1. General notices
凡例
﹒2.2.5. Relative density
相对密度
﹒2.2.29. Liquid chromatography
液相色谱
﹒2.2.31. Electrophoresis
电泳法
﹒2.4.23. Sterols in fatty oils
脂肪油中的甾醇
﹒2.4.25. Ethylene oxide and dioxan
环氧乙烷和二恶英
﹒2.4.26. N,N-Dimethylaniline
NN-二甲基苯胺
﹒2.4.32. Total cholesterol in oils rich in omega-3 acids
富含欧米伽-3酸的油中的总胆固醇
﹒2.5.19. O-Acetyl in polysaccharide vaccines
多糖疫苗中的O-乙酰
﹒2.5.37. Methyl, ethyl and isopropyl methanesulfonate in methanesulfonic acid
甲磺酸中的甲基、乙基和亚丙基磺酸
﹒2.5.38. Methyl, ethyl and isopropyl methanesulfonate in active substances
活性物质中的甲基、乙基和甲磺酸异丙酯
﹒2.5.39. Methanesulfonyl chloride in methanesulfonic acid
甲磺酸中的甲基酰氯
﹒2.5.40. Methyl, ethyl and isopropyl toluenesulfonate in active substances
活性物质中的甲基、乙基和甲苯磺酸异丙酯
﹒2.5.41. Methyl, ethyl and isopropyl benzenesulfonate in active substances
活性物质中的甲基、乙基和异丙基苯磺酸盐
﹒2.7.8. Assay of tetanus vaccine (adsorbed)
破伤风疫苗的测定(吸附)
﹒2.8.9. Residue on evaporation of essential oils
精油蒸发残渣
﹒2.9.10. Ethanol content
乙醇含量
﹒ 2.9.11. Test for methanol and 2-propanol
甲醇和2丙醇的检验
﹒3.1.14. Materials based on plasticised poly(vinyl chloride) for containers for aqueous solutions for intravenous infusion
用于静脉输液容器的塑料聚合物(氯乙烯)材料
﹒3.2. Containers
容器
﹒5.1.2. Biological indicators and related microbial preparations used in the manufacture of sterile products
用于无菌产品生产的生物指示剂及相关微生物制品
﹒5.1.6. Alternative methods for control of microbiological quality
微生物质量控制的替代方法
﹒5.2.12. Raw materials of biological origin for the production of cell-based and gene therapy medicinal products
生产细胞和基因治疗药品的生物原料
﹒5.9. Polymorphism
多晶型
﹒5.10. Control of impurities in substances for pharmaceutical use
药用物质的杂质控制
﹒5.12. Reference standards
标准品
﹒5.15. Functionality-related characteristics of excipients
辅料的功能相关特性
﹒5.16. Crystallinity
结晶性





此外,还有一部分修改了标题和编号。

来源:GMP办公室